|
RECOMENDAÇÕES
Tratamento do IAM - SOCERJ
Coordenação:
César Cardoso de Oliveira - Presidente da SOCERJ
Eduardo Nagib Gaui - Presidente do DDC
Luiz Antonio Campos - Diretor Científico
Participantes
Claudio Gil Soares Nelson Bärg
Glaucia Moraes Ricardo Mourilhe Rocha
Helio Roque Figueira
Jayme de Barros Freitas Roberto Esporcatte
Myriam Solange Pereira Bueno Vinicio Elia Soares
I- INTRODUÇÃO
Dados do Ministério da Saúde relativos ao ano de 1996 nos fazem saber que o
Estado do Rio de Janeiro possui a maior taxa bruta de mortalidade dentre os
estados da região sudeste e a quarta maior do Brasil (8,2 óbitos por 1000
hab.). As doenças cardiocirculatórias são responsáveis pela maioria dos
óbitos na população adulta. No Estado do Rio de Janeiro 33,6% de todos os
óbitos têm como causa doenças do aparelho cardiocirculatório e este número
chega à 37,9% quando focamos apenas a população com mais de 35 anos de idade
independente do sexo.
Ainda segundo a mesma fonte, a taxa específica de mortalidade por doença
isquêmica do coração é, no nosso estado, de 84,2 óbitos por 100.000
habitantes, considerando todas as faixas etárias; taxa esta que assume
valores de 440,6 por 100.000 habitantes quando observamos a população acima
dos 35 anos de idade. Estes números surpreendem quando constatamos que esta
é a maior taxa de mortalidade por doença isquêmica do coração dentre todos
os estados brasileiros.
Outros dados importantes podem ser obtidos a partir do Projeto BÚSSOLA,
trabalho que teve como objetivo avaliar a utilização da terapia trombolítica
e a disponibilidade de recursos técnicos e humanos para o atendimento a
pacientes com diagnóstico de infarto agudo do miocárdio (IAM) nas unidades
de emergência da cidade do Rio de Janeiro e, nos faz tomar ciência de que em
33,4% das emergências da rede pública não há drogas trombolíticas
disponíveis.
Estes dados acima assumem significativa importância quando hoje sabemos que
quando um paciente com suspeita de IAM chega ao setor de emergência, a
avaliação diagnóstica e da terapêutica deve ocorrer o mais rapidamente
possível pelos benefícios que a reperfusão oferece, especialmente quando
iniciada precocemente. Em comparação com o tratamento clássico, a terapia
trombolítica traz uma redução proporcional de 21% de mortalidade nos
primeiros 35 dias em pacientes com IAM e elevação de segmento ST, o que
corresponde à redução global de 21 mortes por cada 1000 pacientes tratados.
O maior benefício ocorre quando a trombólise é instituída nas primeiras 6
horas a partir do início dos sintomas, apesar de ainda haver benefício
observado quando utilizada nas primeiras 12 horas. Estima-se que 35 vidas
por cada 1000 pacientes tratados sejam salvas quando a terapia trombolítica
se inicia na primeira hora desde o início dos sintomas comparado com 16
vidas salvas quando tratamos o paciente entre a 7ª e a 12ª hora.
Diante do que foi apresentado, o Departamento de Doença Coronariana da
Sociedade de Cardiologia do Estado do Rio de Janeiro elaborou este documento
que pretende ser mais um instrumento prático de consulta para os
profissionais da área de saúde que lidam no seu cotidiano com a suspeita ou
diagnóstico estabelecido de IAM.
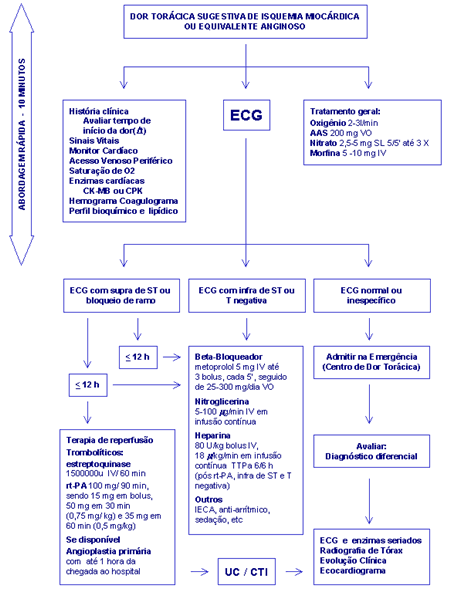
II- ABORDAGEM INICIAL
Para que o diagnóstico de IAM seja realizado é necessário a presença de pelo
menos dois dos seguintes critérios: história ou dor precordial do tipo
isquêmica, alterações evolutivas no ECG e nos marcadores séricos de necrose
miocárdica.
A dor é usualmente precordial retro-esternal, tipo constrictiva, em aperto,
queimação ou peso, de duração maior que 30 minutos, com ou sem irradiação (mandíbula,
dorso, região epigástrica, membros superiores ou todo o precórdio),
acompanhada de náuseas, sudorese, vômitos, diarréia, palidez cutânea e mal
estar geral. Em alguns casos, o paciente não apresenta dor torácica, mas
equivalentes de dor como astenia, cansaço, dispnéia aos esforços, dispnéia
paroxística noturna ou edema pulmonar agudo.
Devemos lembrar que um número expressivo de pacientes se apresenta na fase
superaguda do IAM com ECG absolutamente normal ou com alterações
inespecíficas, sendo mandatório para este subgrupo um período maior de
observação para a definição diagnóstica. A realização de ECG seriados
colaboram para o diagnóstico final.
A tabela 1 correlaciona as alterações do ECG com os tipos de IAM e suas
principais complicações. Usualmente há dominância esquerda, porém as
variações anatômicas são freqüentes. A elevação do segmento ST maior ou
igual a 1 mm deverá ser vista em duas ou mais derivações anatômicas
contíguas.
TABELA 1
|
Tipo de IAM
|
Alteração no ECG |
Artéria relacionada |
Complicações |
| Septal |
V1- V4 |
Descendente anterior |
Bloqueio infranodal e de ramos |
| Anterior |
V3- V4 |
Ramo diagonal |
Disfunção de VE, ICC, BRE/BRD, BAVT, ESV |
| Lateral |
V5- V6 – DI- AVL |
Circunflexa |
Disfunção de VE, BAV nodal |
| Inferior |
DII- DIII- AVF |
Descendente posterior |
Hipotensão, sensibilidade à NTG e Morfina, BAV nodal |
| VD |
V3r-V4r (DII,DIII,AVF) |
Coronaria direita |
Hipotensão, BAV, FA, Flutter, ESA,
Reação adversa à drogas |
| Posterior |
V1 a V4, V7 e V8 |
Ramo circunflexo Descendente posterior |
Disfunção VE |
Os marcadores séricos de necrose miocárdica usualmente
utilizados são a creatinofosfoquinase ( CK) e a sua fração MB (CK-MB), porém
outros podem ser utilizados, como a mioglobina e as troponinas T e I.
A dosagem de CPK pode estar elevada também nos casos de doenças musculares,
diabetes mellitus, intoxicação alcoólica, trauma muscular esquelético,
exercício vigoroso, convulsões, injeções intra-musculares e tromboembolismo
pulmonar. A CK-MB também pode se elevar nos grandes traumas; cirurgias ou
infarto de intestino delgado; enfermidades, traumas ou cirurgias na lingua,
diafragma, útero e próstata.
Nos centros aonde forem disponíveis, a mioglobina (alta sensibilidade/baixa especificidade), a troponina I ou T (alta sensibilidade e
especificidade) e a CK-MB massa (técnica de imunoensaio que utiliza
anticorpos monoclonais diretamente contra a CK-MB, mais precoce e mais
específica que esta) podem fazer parte do protocolo de avaliação da dor
torácica.
A tabela 2 nos mostra a relação da detecção dos marcadores séricos de dano
miocárdico com o intervalo de tempo.
TABELA 2
|
Marcadores séricos |
Detecção inicial |
Máxima atividade |
Normalização média |
| Mioglobina |
1 a 3 horas |
6 a 9 horas |
36 horas |
| Troponina T |
2 a 4 horas |
12 horas |
10 a 14 dias |
| Troponina I |
4 a 6 horas |
12 horas |
7 a 10 dias |
| CK-MB |
3 a 5 horas |
24 horas |
2 a 4 dias |
| CK total |
4 a 8 horas |
12 a 24 horas |
3 a 4 dias |
A ecocardiografia Doppler é útil não só na detecção da
doença coronariana, bem como para traçarmos o prognóstico da mesma. A
presença de anormalidades da contração segmentar associada a dor prolongada,
mesmo com clínica não característica e ECG não diagnóstico, é altamente
sugestiva de IAM; enquanto que a ausência da mesma ou a presença de
disfunção que acometa difusamente o VE têm alto valor preditivo negativo. É
importante lembrarmos que as anormalidades segmentares dos ventrículos se
apresentam também em outras situações clínicas, como por exemplo:
miocardites, cardiomiopatias, sepsis e outras síndromes isquêmicas
miocárdicas. Não é ainda possível com a ecocardiografia convencional a
distinção entre a isquemia e a necrose miocárdica agudas.
O diagnóstico diferencial do IAM deverá ser feito com outras condições como
dissecção aórtica, tromboembolismo pulmonar, pericardite, doenças
músculo-esqueléticas, herpes zoster, doença péptica, colecistite ,
pancreatite aguda, ruptura de esôfago e pneumonias.
III- TERAPIA DE REPERFUSÃO:
O processo agudo trombótico oclusivo da artéria coronária, que ocorre em uma
placa ateroesclerótica vulnerável, determina o desenvolvimento da necrose
miocárdica. O pronto e efetivo restabelecimento do fluxo sangüíneo, que pode
ser atingido tanto por drogas trombóliticas quanto pela angioplastia
primária, determina significativa redução da mortalidade e preservação da
função ventricular.
III-1- Terapia Trombolitica:
A administração das drogas trombolíticas por via venosa é um procedimento
seguro e simples de ser realizado, e comprovadamente eficaz na diminuição da
mortalidade e das complicações do IAM. A trombólise não requer condições
especiais, podendo ser feita em salas de emergência que possuam recursos
mínimos como um desfibrilador e monitor cardíaco.
INDICAÇÕES
Dor precordial típica e ECG com:
-
Supra desnível do segmento ST maior do que 1 mm em pelo
menos duas derivações que explorem a mesma parede nas derivações
periféricas, ou um supra desnível de ST maior que 2 mm em pelo menos
duas derivações contíguas no plano horizontal.
Bloqueio de ramo no ECG.
-
Nos pacientes com evolução acima de 12 horas que
mantenham dor persistente e supra de ST, a terapia com trombolíticos
deve ser considerada, afastados os diagnósticos de pericardite e
dissecção aórtica.
CONTRA-INDICAÇÕES:
Absolutas:
-
Sangramento interno em atividade (exceto menstruação).
-
Suspeita de dissecção aórtica.
-
Neoplasia intracraniana conhecida.
-
História de acidente vascular encefálico (AVE)
hemorrágico em qualquer tempo; outros AVE ou eventos cerebrovasculares
no último ano.
Relativas:
-
Hipertensão arterial grave mantida (>180 mmHg de
sistólica e > 110 mmHg de diastólica)
-
Ressuscitação cardio-respiratória traumática (fraturas
de costelas, pneumotórax, intubação oro-traqueal traumática, etc.) ou
prolongada > 10 min.
Gravidez
Trauma recente, incluindo trauma de crânio, até 2 a 4 semanas.
-
Outras doenças intracranianas
-
Uso de anticoagulante (INR > 2), diátese hemorrágica
conhecida
-
Punções vasculares não compressíveis.
-
Uso de estreptoquinase nos últimos 24 meses;
antecedentes de reação alérgica a estreptoquinase.
-
Neoplasia ou doença com possível anormalidade torácica,
abdominal ou intracraniana.
-
História de hipertensão arterial crônica grave.
-
Úlcera péptica ativa.
-
Sangramento interno recente (2 a 4 semanas).
-
Grande cirurgia até 3 semanas
Os agentes trombolíticos aprovados para o uso no Brasil são:
* Estreptoquinase : 1,5 milhões de unidades em 1 hora de infusão (solução de
dextrose a 5% ou fisiológica a 0,9%).
* Ativador do plasminogênio tecidual (rt-PA) :
- Forma acelerada: 15 mg em bolus, seguido de 0,75 mg/Kg em 30 minutos (não
exceder 50 mg), e mais 0,5 mg/Kg nos próximos 60 minutos (dose máxima de 35
mg), em solução de dextrose a 5% ou solução fisiológica a 0,9%
A escolha dos agentes trombolíticos baseia-se em nosso meio principalmente
na disponibilidade e custo, sendo a estreptoquinase a opção preferencial. No
entanto outros fatores devem ser considerados. Parece haver maior benefício
com o rt-PA nos infartos extensos, com delta T curto e baixo risco de
hemorragia intra-cerebral. Por outro lado, a STK traz maiores benefícios nos
IAM que se apresentem tardiamente, nos que tenham maior risco de hemorragia
intra-craniana e naqueles com menor quantidade de miocárdio em risco.
A terapia trombolítica está associada com um maior risco de AVE. Os
seguintes fatores parecem ter importância nesta asociação: idade > 65 anos,
baixo peso corporal (<70 kg), hipertensão inicial (PA> 180/110 mmHg) e uso
de anticoagulantes. Deve-se tentar a redução das cifras tensionais antes de
iniciar a terapia trombolítica, embora esta estratégia não tenha demonstrado
claramente redução na incidência de AVE.
Quando utilizada em hospitais conveniados ao Sistema Único de Saúde(SUS),
estes são reembolsados, baseado em tabela publicada no Diário Oficial da
União – DOU, no 112 de junho de 1994. Por cada frasco de estreptoquinase
utilizada (250.000UI), o SUS paga R$88,27. Portanto para o tratamento aceito
universalmente de 1.500.000 UI, o SUS reembolsa R$529,62. Para tanto o
hospital deverá comprovar o uso da estreptoquinase e remeter ao SUS o
formulário de reembolso do paciente com o código apropriado. Para cada
ampola utilizada de 250.000 UI da medicação há um código para o procedimento
"estreptoquinase 250.000 UI" como exemplificado a seguir:
- Quantidade/código: 01 unidade /99-063-01-8; 02 unidades/ 99-063-02-6; 03
unidades /99-063-03-4; 04 unidades / 99-063-04-2; 05 unidades/ 99-063-05-0;
06 unidades/ 99-063-06-9.
III-2- ANGIOPLASTIA TRANSLUMINAL CORONÁRIA (ATC):
É importante que se definam alguns termos freqüentemente confundidos em
relação à abordagem do IAM através a angioplastia transluminal coronária (ATC):
- Angioplastia primária (ou angioplastia direta): ATC realizada nas
primeiras 6-12 h do IAM, sem uso prévio de trombolíticos.
- Angioplastia de resgate (ou salvamento): ATC realizada após o insucesso da
terapêutica trombolítica.
- Angioplastia imediata: ATC que se realiza imediatamente após a terapia
trombolítica bem sucedida.
- Angioplastia tardia: ATC que se realiza entre 1 e 7 dias, antes da alta
hospitalar, com ou sem uso prévio de trombolíticos.
Apesar das vantagens comprovadas da terapia trombolítica, algumas limitações
persistem:
- Cerca de 20% das artérias relacionadas ao infarto (ARI) permanecem
ocluidas e cerca de 45% destas, tinham o fluxo restabelecido em apenas TIMI
2 (tabela 3)
- Não existe, até o momento, nenhum marcador clínico, eletrocardiográfico ou
laboratorial eficaz e confiável de que ocorreu a reperfusão efetiva
- A isquemia recorrente ocorre em 15 a 30 % dos pacientes.
- Nível elevado de acidentes vasculares encefálicos hemorrágicos: 0.5 à 1.5%.
Classificação de fluxo coronariano utilizada no estudo TIMI:
|
TIMI 0 |
Ausência de fluxo na artéria
relacionada ao infarto (ARI) |
|
TIMI 1 |
Pequena quantidade de constraste ultrapassa a
obstrução da ARI
|
|
TIMI 2 |
O contraste ultrapassa e perfunde a ARI até sua
porção distal com fluxo lento |
|
TIMI 3 |
Fluxo normal na ARI |
Em função destes problemas a angioplastia no IAM surgiu e
desenvolveu-se como uma alternativa eficiente.Vários estudos que compararam
ATC primária com o uso de trombolíticos constataram superioridade da
primeira em relação à mortalidade intra e extra-hospitalar, isquemia
recorrente, taxas de acidentes vasculares hemorrágicas, tempo de internação,
taxa de reinfarto e revascularização da lesão alvo.
A utilização de dispositivos intracoronários (Stent) permitiu superar
importantes limitações da ATC convencional: altas taxas de reinfarto, os
episódios de isquemia recorrente na fase hospitalar, reoclusão, reinfarto
tardio, impossibilidade de se abordar lesões complexas e as ainda
preocupantes taxas de reestenose (20% a 40%).
O tratamento trombolítico deve ser sempre utilizado nos casos em que não
exista laboratório de hemodinâmica disponível e/ou hemodinamicistas
experientes. Entretanto, nos casos inelegíveis para tratamento trombolítico,
nos casos sem sinais de reperfusão, nos infartos extensos, nos pacientes com
instabilidade hemodinâmica ou choque cardiogênico, deve ser considerada a
possibilidade de transferência imediata para outro hospital próximo, que
disponha de um laboratório de hemodinâmica.
Evidentemente nem sempre as condições ideais estão disponíveis na grande
maioria dos hospitais, especialmente no Brasil. Poucos centros (menos de 20%
nos EUA e menos de 10% na Europa) têm facilidades para angioplastia primária
e, estes números são menores ainda considerando-se apenas aqueles que
funcionam em regime de 24 horas todos os dias da semana.
A tabela 3 resume as principais vantagens e desvantagens destas duas
terapias de reperfusão.
TABELA 3
| ASPECTOS |
ANGIOPLASTIA
|
TROMBÓLISE |
| 1) Taxa de reperfusão |
acima de 90% |
entre 55 e 80% |
| 2) Obtenção de fluxo TIMI 3 |
acima de 90% |
inferior a 50/60 % |
| 3) Contra-indicações |
menos freqüentes |
mais freqüentes |
| 4) Lesão resdual |
pode ser tratada |
não pode ser tratada |
| 5) Identificação da reperfusão |
imediata e precisa |
não definida |
| 6) Identificação de outras lesões |
possível |
impossível |
| 7) Aspectos logísticos |
maior complexidade |
menor complexidade |
| 8) Choque cardiogênico |
maior benefício |
menor benefício |
| 9) Acidente Vascular Encefálico |
menor freqüência |
maior freqüência |
| 10) Dúvida diagnóstica |
oferece auxílio |
não oferece auxílio |
| 11) Uso de balão intra-aórtico |
facilidades |
riscos do estado lítico |
| 12) Ruptura cardíaca |
menor incidência |
maior incidência |
| 13) Disponibilidade |
menor |
maior |
| 14) Custo inicial Custo final |
maiores tendem a ser menores |
menores variável |
Após a ATC, a heparina endovenosa deve ser empregada em
doses plenas por 48h de rotina e a AAS 200 mg VO indefinitamente. Quando do
uso de Stent, emprega-se ticlopidina 500 mg de 12/12 horas nas primeiras
48/72 horas (nos pacientes não pré-tratados) seguida de 250 mg de 12/12 h
durante 30 dias. Nos pacientes de alto risco deve-se considerar o uso de
heparina de baixo peso molecular por uma a duas semanas.
IV -DROGAS COADJUVANTES NO TRATAMENTO DO IAM:
1- Aspirina e outros antiagregantes plaquetários:
- Reduz a mortalidade do IAM em 23% quando isolada e em 42% quando associada
à estreptoquinase.
- Dose diária de 160-325 mg (utilizamos 200 mg) sendo iniciada o mais
precoce possível , em todos os pacientes exceto quando há contra-indicação
ou hipersensibilidade à aspirina.
- Não há evidências de que dipiridamol, ticlopidina e clopidogrel sejam
superiores à aspirina.
Os agentes inibidores dos receptores de glicoproteína IIb/IIIa, como o
abciximab, tirofiban e o lamifiban, parecem induzir à patência vascular mais
rapidamente e com melhor fluxo e reperfusão mais estável, porém, não existem
ainda evidências que nos faça recomenda-los de forma rotineira no IAM.
2- Oxigênio:
- A hipoxemia é frequente mesmo no IAM não complicado.
- Deve-se suplementar oxigênio 2-4 l/min por cateter nasofaríngeo ou máscara
a todos os pacientes com suspeita de isquemia miocárdica aguda, nas
primeiras 3-4 horas. Posteriormente, deve ser monitorado com a oximetria de
pulso, e ofertá-lo a fim de manter a saturação de O2 maior ou igual a 90%.
Em presença de congestão pulmonar ou instabilidade hemodinâmica as
estratégias de suporte ventilatório deverão ser imediatamente implementadas,
e serão mais ou menos invasivas de acordo com a gravidade da hipoxemia,
congestão pulmonar, hipotensão, depressão sensorial e alterações metabólicas
associadas.
- Atenção para pacientes com doença pulmonar obstrutiva crônica (DPOC), já
que a hipoxemia diminui o estímulo respiratório.
3- Analgesia e Sedação
ANALGESIA - Morfina
- Age por mecanismo não bem conhecido no sistema nervoso central e promove
vasodilatação arterial e venosa. Em parte os efeitos são decorrentes de ação
simpaticolítica. Tem potente ação analgésica. Tem como efeito hemodinâmico a
redução da pré-carga e da resistência vascular sistêmica, diminuindo o
consumo de oxigenio. Oferece benefício por diminuição do esforço e do
trabalho respiratório, e por suas propriedades analgésicas.
- Dose inicial de 2 a 4mg IV a cada 5 a 30 minutos (máximo de 15mg/hora em 3
horas), em pacientes com dor, edema agudo de pulmão, evitando-se administrá-la
em casos de hipovolemia ou pressão sistólica menor que 90 mmHg (evitar via
IM por interferir com os marcadores séricos).
- Pode promover depressão respiratória, nauseas e vômitos devendo ser
utilizada com cautela em pacientes idosos, nos portadores de DPOC e em casos
de hipercapnia.
SEDAÇÃO
- Visa diminuir a ansiedade e por conseguinte, o consumo de O2.
- Bromazepam 3 mg ou Diazepam 5 mg por via oral cada 8-12 horas como dose
inicial.
- Haloperidol IV para os distúrbios de comportamento (agitação e delírio que
podem ocorrer principalmente em pacientes idosos, com déficit cognitivo e
confinamento prolongado, ou mesmo como reação adversa à alguma droga (como
por exemplo lidocaína, mexiletine, procainamida, atropina, cimetidina e
meperidina).
4- Nitratos
- Agem promovendo relaxamento da musculatura lisa vascular por liberarem
óxido nítrico, com maior efeito sobre as veias e também inibem a endotelina
induzida pela trombina, diminuindo ainda a agregação plaquetária. Tem como
efeito hemodinâmico redução da pré-carga e em menor grau da pós-carga,
vasodilatação e redistribuição do fluxo coronariano . Em doses mais elevadas
também pode reduzir a pós-carga. Oferece benefício adicional pelo alívio da
isquemia miocárdica.
- A nitroglicerina é administrada em infusão venosa contínua de 10 a 200 &-
109; g/min. Preparados para emprego por via sublingual (dinitrato de
isossorbida- 5 mg) podem ser administrados repetidas vezes (até três tomadas)
a curtos intervalos de tempo (a cada 5 ou 10 minutos), salvo na presença de
hipotensão arterial. Embora os grandes estudos não tenham demontrado redução
da mortalidade com esta droga recomenda-se sua utilização de rotina nas
primeiras 24 horas. Já no IAM complicado por hipertensão, insuficiência
cardíaca congestiva e angina persistente ou recorrente, utilizaremos
preferencialmente a nitroglicerina venosa nas primeiras 24-48 horas.
- O efeito adverso mais importante é a hipotensão, especialmente quando
associada ao IAM de ventrículo direito (VD) ou hipovolemia. Eventualmente a
nitroglicerina pode promover bradicardia, aquicardia, síncope, cefaléia e
piora das trocas gasosas pulmonares com hipoxemia.
- Em linhas gerais deve-se evitar o uso, ou fazê-lo com cautela, quando a
pressão arterial sistólica for menor que 90 mmHg e a frequência cardíaca
maior que 100 batimentos por minuto (bpm) mesmo em baixas doses.
5- Betabloqueadores
- Reduzem a frequência cardíaca e o estado contrátil do miocárdio (inotropismo
negativo) determinando redução do consumo de O2 e aumento do enchimento
coronariano por prolongarem a diástole. Reduzem o potencial arritmogênico do
miocárdio isquêmico , a frequência de arritmias ventriculares complexas,
aumentam o limiar de fibrilação ventricular, diminuem a incidência de
ruptura cardíaca, promovem a redução da isquemia recorrente e da extensão da
zona infartada . Agem efetivamente na redução da mortalidade do IAM.
- As principais contra-indicações são bradicardia (< 60 bpm), distúrbio de
condução atrioventricular de 2º e 3º graus ou 1º grau, se o intervalo PR
>240 ms, pressão arterial sistólica <100 mmHg ou baixo débito, insuficiência
ventricular esquerda, DPOC grave, asma brônquica, doença vascular periférica
grave ou experiência prévia adversa com a droga.
- Atenolol ou metoprolol 5mg por via IV cada 5 a 10 minutos (total 15 mg)
até a obtenção dos efeitos desejados, ou seja, duplo produto (frequência
cardíaca multiplicada pela pressão arterial sistólica) entre 6.000 e 8.000.
O propranolol é utilizado na dose de 1 mg IV cada 5 minutos, com dose máxima
de 5 mg. Na dúvida quanto à tolerância da droga, recomenda-se um teste com o
esmolol (reduzida meia-vida= 9-10 minutos) com bolus de 0,5 mg/kg, seguido
de infusão de 0,05 mg/kg Após 10 a 20 minutos, e na ausência de efeitos
adversos, iniciamos manutenção oral com atenolol ou metoprolol nas doses de
25-50 mg cada 12 horas, ou propranolol, 10-40 mg cada 6-8 horas.
6- Bloqueadores dos canais de cálcio
- Não se observou redução da mortalidade em nenhum dos principais grandes
ensaios clínicos, na abordagem inicial do IAM, tanto com verapamil como com
diltiazem. A administração de nifedipina, que não reduz a frequência
cardíaca, pode aumentar a mortalidade, sem redução da incidência de
reinfarto, parecendo este efeito ser dose dependente (> 60 mg/dia)
- Somente serão utilizados, como drogas alternativas, após o nitrato e os
betabloqueadores, na isquemia persistente ou recorrente, na hipertensão
arterial e na contra-indicação aos betabloqueadores, dando-se preferência ao
diltiazem ou verapamil.
7-Inibidores da Enzima Conversora da Angiotensina (IECA)
- Por reduzirem o estresse parietal ventricular, atuando na pré e pós-carga,
são capazes, principalmente nos infartos anteriores e nos extensos, de
atenuar a dilatação e remodelação ventricular melhorando a sobrevida e a
classe funcional pós-IAM.
- Devem ser empregados nas primeiras 24 horas, nos pacientes com IAM
anterior, infartos extensos, insuficiência cardíaca congestiva ou disfunção
ventricular esquerda (recente ou antiga), com fração de ejeção &- 163; 40%,
ou associação de hipertensão arterial. Iniciamos com baixas doses de
captopril (6,25 mg cada 6-8 horas) por via oral, aumentadas progressivamente
(25 mg 6/6h) ou ramipril iniciado com 2,5 mg VO e aumentado posteriormente
para 5 mg 12/12 horas conforme a tolerância.
- Atentar para a presença de hipovolemia ou hiponatremia que podem
potencializar a hipotensão induzida pelos IECA. Não utilizar na gestação (morte
ou injúria fetal), se a pressão sistólica < 100 mmHg, se houver história de
estenose bilateral das arterias renais ou alergia aos IECA.
8- Anticoagulantes
- O uso de heparina não-fracionada no IAM é mandatório se for realizada
trombólise com rt-PA (diminuição da taxa de reoclusão coronariana), após ATC
ou revascularização do miocárdio
(manutenção da patência da ARI), nos pacientes com depressão aguda do
segmento ST ou inversão da onda T (prevenção da formação de trombo ou
ruptura de placa), e nos infarto anteriores extensos (prevenção de trombose
mural).
- Inicia-se com bolus de 80 U/kg seguida de infusão de 18 U/kg/h,
concomitante à administração do rt-PA e mantida por 48 horas, objetivando
manter o tempo de tromboplastina parcial ativado (TTPa) 1,5-2 vezes o
controle, ou entre 60-85 segundos. O TTPa deve ser verificado a cada 6 h
após o início da heparina, até a obtenção dos níveis desejados, conforme
tabela anexa.
Tabela de anticoagulação
|
Dose Inicial |
80 U/Kg em bolus, depois 18U/Kg/h |
|
TTPa < 35s ( <1,2 x o controle) |
80 U/Kg em bolus, depois 4U/Kg/h |
|
TTPa entre 35 a 45 s (1,2 a 1,5 x o
controle) |
40 U/Kg bolus, depois 2 U/Kg/h |
|
TTPa entre 46 a 70 s (1,5 a 2,3 x o
controle) |
Manter |
|
TTPa entre 71 a 90 s (2,3 a 3 x o
controle) |
Diminuir a infusão para 2 U/Kg/h |
|
TTPa > 90 s ( > 3 x o controle) |
Parar a infusão por 1 h, reiniciar após com 3 U/Kg/h |
- A maioria dos pacientes infartados necessitará apenas de
profilaxia para trombose venosa profunda com a utilização de heparina de
baixo peso molecular, que poderá ser suspensa assim que for iniciada a
deambulação. Vale ressaltar que para infartos não complicados o período de
imobilização no leito pode ser restrito a 24-48 horas.
- Com a utilização de estreptoquinase não se recomenda o emprego de heparina
IV.
9- Sulfato de Magnésio
- Não há evidências para a administração rotineira de magnésio no IAM, porém
o seu nível sérico deverá ser monitorado desde a admissão e reposto quando
necessário. Outra indicação é a presença de arritmias ventriculares, em
especial taquicardia ventricular do tipo "torsade de pointes".
- Administrar 1 a 2g (8 a 16 mEq) de sulfato de magnésio, diluídos em
50/100 ml de SG 5%, em 15-30 minutos. Manter a infusão de 0,5-1,0 g por hora
nas próximas 12/24 horas.
10- Drogas Hipolipemiantes
- O perfil lipídico deve ser avaliado nas primeiras 24 horas de evolução do
IAM já que, após este período poderá ocorrer uma falsa redução dos níveis de
colesterol relacionada a doenças agudas.
- Os hipolipemiantes podem ser empregados precocemente desde haja
estabilidade clínica.
V- IAM complicado:
IV-1- DISTÚRBIOS HEMODINÂMICOS:
Os distúrbios hemodinâmicos no IAM podem ser decorrentes de: extensa necrose
e/ou isquemia miocárdica de VE e VD e complicações mecânicas. Podem
ocorrer secundário a causas não cardíacas como: hipovolemia, embolia
pulmonar, distúrbios metabólicos, eletrolíticos e alterações hemodinâmicas
distributivas por resposta inflamatória sistêmica. O choque cardiogênico, a
mais grave expressão clínica dos distúrbios hemodinâmicos no IAM, ainda
ocorre atualmente em torno de 5% a 7% dos pacientes e sua mortalidade se
mantém no patamar de 70% a 80% quando não se obtém a reperfusão da ARI.
A avaliação dos distúrbios hemodinâmicos baseada apenas em dados clínicos e
radiológicos muitas vezes não é suficientemente precisa para orientação de
intervenções terapêuticas no IAM complicado, sendo recomendada a monitoração
hemodinâmica invasiva com o cateter de Swan-Ganz.
O conjunto de dados obtidos com o emprego do cateter de Swan-Ganz torna
possível estimativas do estado volêmico, do tônus vascular, do desempenho
ventricular, da função pulmonar e da oxigenação tecidual auxiliando na
avaliação diagnóstica e terapêutica evolutivas.
Deve-se considerar o emprego do cateter de Swan-Ganz: no choque cardiogênico
que não responde imediatamente à reposição volêmica, no edema agudo de
pulmão sem resposta adequada às intervenções terapêuticas e/ou com
hipotensão no curso do tratamento, para auxílio no esclarecimento
diagnóstico da suspeita de complicação mecânica (ruptura do septo
interventricular, músculo papilar, parede livre de VE e tamponamento) e na
dúvida entre edema pulmonar cardiogênico e não cardiogênico visando
adequação terapêutica.
As relações entre manifestações clínicas, perfil hemodinâmico e mortalidade
nos pacientes com IAM foram documentadas por Killip e por Forrester. Embora
tais publicações sejam anteriores à era da terapia trombolítica, por serem
extremamente consagradas, serão a seguir apresentadas.
Classificação de Killip:
| Grupo |
Aspectos
Clínicos |
Freqüência* |
Mortalidade**
|
|
I |
Sem sinais de congestão pulmonar |
40 – 50% |
6% |
|
II |
B3, estertores pulmonares bibasais |
30 – 40% |
17% |
|
III |
Edema agudo de pulmão |
10 – 15% |
38% |
|
IV |
Choque cardiogênico |
5– 10% |
81% |
Classificação de Forrester:
| Grupo |
Aspectos
Hemodinâmicos |
Freqüência* |
Mortalidade** |
|
I |
POAP < 18 mmHg; IC > 2,2 l/min/m2 |
25% |
3% |
|
II |
POAP > 18 mmHg; IC > 2,2 l/min/m2 |
25% |
9% |
|
III |
POAP < 18 mmHg; IC < 2,2 l/min/m2 |
15% |
23% |
|
IV |
POAP > 18 mmHg; IC < 2,2 l/min/m2 |
35% |
51% |
Freqüência aproximada, ** mortalidade hospitalar, POAP –
pressão de oclusão deartéria pulmonar, IC –índice cardíaco.
A gravidade do IAM relaciona-se diretamente à extensão da lesão isquêmica
miocárdica. Estima-se que, com o acometimento isquêmico de 8% do ventrículo
esquerdo haja diminuição da complacência diastólica, com 15% redução da
fração de ejeção, com 25% há evidências clínicas de insuficiência
ventricular esquerda e com 40% choque cardiogênico. As metas terapêuticas na
abordagem da disfunção de VE complicando o IAM devem ser direcionadas para:
manutenção do débito cardíaco e da pressão sistêmica de perfusão tecidual,
redução da hipertensão venosa pulmonar e da pressão hidrostática capilar
pulmonar, otimização da pressão de perfusão diastólica para o leito vascular
coronário, controle dos determinantes hemodinâmicos do consumo miocárdico de
oxigênio.
As opções terapêuticas para obtenção dessas metas
incluem:
-
medidas de ordem geral (utilização de agentes
antiplaquetários e anticoagulantes; terapia com oxigênio, suporte
mecânico ventilatório invasivo e não invasivo; correção de distúrbios do
equilíbrio eletrolítico e ácido-base; reversão do efeito inotrópico
negativo induzido por drogas; controle de arritmias e correção da
anemia).
-
adequação de infusão de fluidos e intervenções
farmacológicas (otimização da pré-carga e da pós-carga e suporte
hemodinâmico farmacológico com inotrópicos positivos).
-
terapia de reperfusão ou revascularização
-
suporte mecânico circulatório ( balão de contrapulsação
intra-aórtica- BIA)
O emprego do BIA deve ser considerado em distúrbios
hemodinâmicos refratários ou com resposta terapêutica insatisfatória e com
condições passíveis de reversão. É particularmente importante nas
intervenções coronárias percutâneas e no manejo perioperatório de
revascularização miocárdica cirúrgica. Nesta apresentação clínica a
angioplastia coronária é superiror a trombólise. A revascularização
miocárdica cirúrgica deve ser considerada em pacientes com anatomia
coronária favorável para esta intervenção, que se apresentem com grave
distúrbio hemodinâmico e que tenham apresentado insucesso ou que não sejam
candidados à terapia trombolítica ou angioplastia.
O choque cardiogênico, antes considerado uma contra-indicação absoluta à
intervenção cirúrgica, hoje têm nesta estratégia uma importante opção
terapêutica. Naqueles que se encontram a menos de 18 horas do IAM observa-se
taxas de sobrevida de até 90%.
O infarto de ventrículo direito com repercussões hemodinâmicas
habitualmente é decorrente de oclusão proximal da artéria coronária direita,
e seu diagnóstico deve ser considerado quando na vigência de infarto
inferior, o paciente apresente hipotensão, turgência jugular e pulmões
limpos. São empregadas as mesmas medidas de ordem geral apresentadas na
abordagem terapêutica da disfunção ventricular esquerda. A suspensão de
nitratos e diuréticos, associada a reposição volêmica vigorosa orientada por
parâmetros clinicos e/ou hemodinâmicos é recomendada nesta complicação.
A regurgitação mitral após o IAM vai desde a disfunção à ruptura do
músculo papilar , pode ser secundária à necrose miocárdica que usualmente
ocorre na primeira semana. Durante os episódios agudos de isquemia,
particularmente em face de função ventricular esquerda prejudicada, a
regurgitação mitral pode aumentar ou diminuir de acordo com a elevação ou a
queda da pressão diastólica final ventricular esquerda ou com a mudança dos
parâmetros da pós-carga. O diagnóstico quase sempre é feito pelo surgimento
de sopro sistólico mitral e congestão pulmonar, em paciente anteriormente
estável. A ecocardiografia com Doppler ou a ventriculografia esquerda
confirmam o diagnóstico. Tentativas de estabilização clínica antes da
cirurgia resultam em taxa de mortalidade de 85 a 90%. A intervenção
cirúrgica precoce permite taxas de sobrevida de 77% a 80% .
A comunicação interventricular (CIV) pós-infarto também se apresenta,
geralmente, na primeira semana. A deterioração nestes pacientes pode ocorrer
em poucas horas e depende do tamanho da CIV e da fração de"shunt"
esquerdo-direito. A suspeição diagnóstica consiste no aparecimento de sopro
sistólico rude paraesternal esquerdo irradiado para a borda esternal direita,
podendo ser confirmado pela ecocardiografia Doppler, pelo salto oximétrico
obtido pelo cateter de Swan Ganz e/ou pela ventriculografia esquerda. Feito
o diagnóstico efetua-se o reparo imediato do CIV.
A ruptura da parede livre de VE é uma condição de difícil diagnóstico
com sobrevida extremamente rara. Têm como características ocorrer mais
comumente no sexo feminino, na sexta década de vida e em hipertensos com
coração pequeno. Ocorre na segunda semana, tendo como mecanismo de morte a
atividade elétrica sem pulso resultante do tamponamento cardíaco.
O diagnóstico do pseudo-aneurisma é geralmente feito semanas a meses
após o IAM. Tais pacientes podem ser assintomáticos ou manifestar sintomas
secundários à doença coronariana concomitante. Devido ao risco elevado de
ruptura, o reparo cirúrgico é mandatório e os resustados são excelentes. O
pseudo-aneurisma deve ser diferenciado do aneurisma verdadeiro
através da ecocardiografia Doppler e este último é abordado posteriormente.
Drogas utilizadas nos distúrbios hemodinâmicos:
Furosemida
-
Diurético potente que age promovendo excreção de cloreto
de sódio na alça de Henle e a causando vasodilatação venosa que é mais
precoce que seu efeito diurético. Tem como efeito hemodinâmico redução
da pré-carga e alívio da congestão pulmonar.
-
Dose inicial de 20 a 40 mg IV (0,5 a 1,0 mg/kg) em bolus, podendo ser repetida até 30-40 mg a cada 6 horas ou em infusão
contínua de 0,25 a 0,75mg/Kg/hora (em um estudo prospectivo até 3,3 mg/hora
por 48h). Tem início de ação em 10 minutos, pico em 30 minutos e se
mantém por 6 horas.
-
Pode reduzir excessivamente a pré-carga em pacientes que
não estejam hipervolêmicos, com efeitos sinérgicos com morfina e
nitratos. Pode causar depleção de sódio, potássio, magnésio e fósforo.
Pode induzir reações alérgicas em pacientes com sensibilidade para
sulfonamidas.
Nitroprussiato de sódio
-
Promove o relaxamento da musculatura lisa vascular por
ligação a receptores específicos. É um vasodilatador balanceado com
redução da pós e da pré-carga. Reduz a pressão capilar pulmonar numa
intensidade maior do que a dobutamina, por sua ação vasodilatadoras e
aumento no relaxamento diastólico de VE.
-
Utilizado em infusão venosa contínua de 0,5 a 8,0 ug/kg/min.
Sua ação se inicia e cessa quase imediatamente. é metabolizado nas
hemácias para ácido hidrociânico, que é convertido para tiocianato pelo
fígado e excretado pelos rins. Assim, devemos ter cautela quando
empregado em vigência de insuficiência renal e hepática pela
possibilidade de intoxicação (alteração do estado mental, náuseas, dor
abdominal, hiperreflexia e convulsões).
-
O efeito adverso mais importante é a hipotensão.
Eventualmente pode piorar as trocas gasosas pulmonares com hipoxemia,
como a nitroglicerina. A possibilidade de redução do fluxo coronário é
controversa. Em linhas gerais deve-se utilizar com cautela quando a
pressão arterial sistólica for menor que 100 mmHg.
Dobutamina
-
Amina simpaticomimética sintética que promove
estimulação adrenérgica dos receptores alfa 1 e beta 1 do miocárdio (age
em receptores alfa 1 periféricos sendo este efeito compensado pela ação
beta 2 mais potente) resultando em vasodilatação leve, que é mais
acentuada quando há aumento do débito cardíaco pela redução da
resistência arterial periférica. Assim, seu efeito hemodinâmico se faz
na redução da pós e pré-carga e no aumento da contratilidade. Aumenta o
fluxo mesentérico e renal, melhorando a função desses órgãos. Contribui
pouco para o consumo miocárdico de O2, com melhora na relação oferta/consumo
e ainda, há incremento do fluxo sangüíneo coronariano pelo efeito
inotrópico positivo, não aumentando, porém a área de infarto.
-
Utilizada em infusão venosa contínua de 2 a 30 ug/kg/min,
evitando incremento de mais de 10% da frenqüência cardíaca basal.
-
Pode promover taquicardia, arritmias cardíacas, isquemia
miocárdia, flutuações da pressão arterial e hipocalemia, quando em doses
elevadas.
Dopamina
- dopaminérgicos (1 a 2 ug/Kg/min = vasodilatação cerebral,
renal e mesentérica)
- beta 1 (2 a 10 ug/Kg/min = aumento do débito cardíaco e pequeno aumento da
resistência vascular periférica)
- alfa 1 adrenérgicos (10 a 20 ug/Kg/min = vasoconstrição renal,
mesentérica, arterial periférica e venosa, aumentando a pré e a pós carga
de forma significativa; > 20 ug/Kg/min = efeitos hemodinâmicos semelhantes
ao da norepinefrina). Aumenta mais o consumo miocárdico de O2, com balanço
negativo da relação oferta/consumo de O2.
-
Utilizada em infusão venosa contínua de 1 a 30 ug/kg/min
( em dose acima de 20 ug/Kg/min é aconselhável troca-la por
noradrenalina)
-
Pode promover taquicardia, arritmias cardíacas supra e
ventriculares, isquemia miocárdia, náuseas e vômitos e necrose tecidual
(se ocorrer extravasamento vascular),
-
Sua ação é potencializada por inibidores da MAO. Quando
usada concomitante à fenitoína pode causar hipotensão. Por ser inativada
em pH alcalino, não deve ser administrada no mesmo cateter venoso com
soluções que contenham aminofilina, fenitoína e bicarbonato de sódio.
Noradrenalina
-
É um potente agente agonista alfa 1 adrenérgico (vasoconstrição arterial e venosa), tem ação beta 1 no miocárdio (efeito
inotrópico positivo) e mínima ação nos receptores beta 2 do coração. Ë
empregada no choque refratário, podendo aumentar a área de infarto, por
aumentar o consumo de O2 e produzir vasoconstrição dos vasos
coronarianos. O aumento da pressão arterial ocorre pelo aumento da
pós-carga, em detrimento do débito cardíaco. Tem utilização restrita no
choque cardiogênico que cursa com hipotensão e resistência vascular
sistêmica aumentada (diferente do choque séptico e neurogênico).
-
Utilizada em infusão venosa contínua de 0,5 a 30 ug/min,
avaliando-se os riscos/ benefícios do emprego de altas doses.
-
Pode promover taquicardia, arritmias cardíacas, isquemia
miocárdia, e necrose tecidual se ocorrer extravasamento vascular.
Milrinone
-
Age através da inibição da fosfodiesterase aumentando os
níveis intracelulares de cAMP. Tem como efeito hemodinâmico redução da
pós-carga, da pré-carga e aumento da contratilidade. Deve ser
considerado no choque cardiogênico refratário aos diuréticos,
vasodilatadores e agentes inotrópicos habituais, enquanto se prepara o
paciente para os procedimentos de revascularização e na vigência de
balão de contra-pulsação aórtica.
-
Utilização em infusão venosa contínua de 0,375 a 0,75 ug/kg/min,
após dose de ataque de 50 ug/kg IV em 10 minutos, com dose máxima de
1,13 mg/kg/ 24h. Para diluição empregamos solução salina a 0,9% em bomba
infusora, com monitorização hemodinâmica concomitante.
-
Pode promover taquicardia (semelhante à da dobutamina)
, arritmias cardíacas, isquemia miocárdia, hipotensão arterial ,
trombocitopenia em 2 a 3 % que parece ser dose dependente, mialgia,
febre e disfunção hepática. Contra-indicada nos pacientes alérgicos à
sulfa.
Uma abordagem racional para os
distúrbios hemodinâmicos no IAM pode ser resumida à seguir:
| CONGESTÃO PULMONAR
|
PRESSÃO ARTERIAL |
EVIDÊNCIAS DE HIPOPERFUSÃO |
ABORDAGEM TERAPÊUTICA INICIAL
SUGERIDA
|
| não |
normal |
não |
tratamento habitual do IAM |
| não |
reduzida |
sim ou não |
reposição com volume 500 ml SF a 0,9% (repetir
infusão de acordo com pressão arterial e ausculta do tórax) |
| não |
elevada |
não |
nitroglicerina (5 - 200 mg/mim IV)
nitroprussiato de sódio (0,5 - 8 mg kg/min IV)
IECA, b-bloqueadores |
| sim |
elevada |
não |
furosemida (0,5 - 1 mg/kg IV)
morfina (2 - 4 mg IV) no EAP
nitroprussiato de sódio (0,5 - 8 mg kg/min IV)
nitroglicerina (5 - 200 mg/mim IV)
IECA: captopril (25 -100 mg VO) |
| sim |
normal |
não |
furosemida (0,5 - 1 mg/kg IV)
morfina (2 - 4 mg IV) no EAP
nitroglicerina (5 - 200 mg/mim IV)
IECA: captopril (25 -100 mg VO) |
| sim |
reduzida 70 - 100 mmHg |
não |
dobutamina (2 - 20 mg/kg/min IV) se refratário
associar dopamina (5 - 30 mg/kg/min IV) |
| sim |
reduzida 70 - 100 mmHg |
sim |
dopamina (5 - 30 mg/kg/min)
se refratário associar noradrenalina (0,5 - 30 ug/kg IV)
considerar BIA, ATC, RM |
| sim |
redução crítica < 70 mmHg |
sim |
noradrenalina (0,5 - 30 ug/kg IV) considerar
assistência ventilatória, BIA, ATC, RM |
VI- COMPLICAÇÕES ELÉTRICAS NO IAM:
O tratamento das arritmias ventriculares não é recomendado quando estas não
provocam alterações hemodinâmicas significativas ou apresentam condições
para o desencadeamento de fibrilação ventricular. Em mais da metade dos
casos nos quais ocorre fibrilação ventricular, as arritmias premonitórias
não estão presentes. Após o início da era trombolítica e o emprego de
betabloqueadores houve diminuição de sua incidência de forma considerável. O
principal determinante de risco é a função ventricular esquerda.
A taquicardia sinusal traduz hiperatividade simpática. Devendo ser avaliada
a presença de ansiedade, dor, insuficiência cardíaca, pericardite,
hipovolemia e ação medicamentosa, sendo o tratamento dirigido para a causa
básica.
As extra-sístoles atriais podem traduzir distensão atrial aguda por
insuficiência cardíaca, pericardite ou isquemia atrial. Normalmente não
necessitam de tratamento específico, devendo ser combatido o fator
desencadeante.
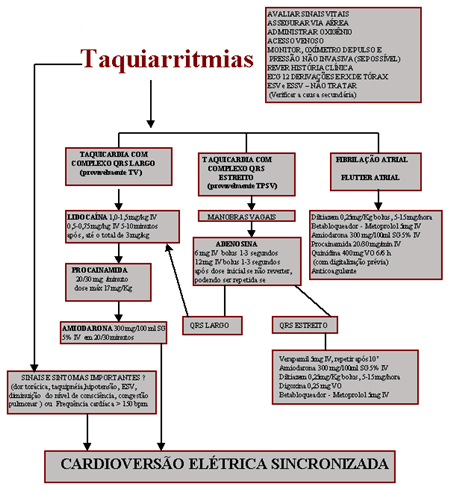
A taquicardia paroxistica supraventricular é rara e freqüentemente exige
medidas de controle da resposta ventricular. Nos casos em que há
instabilidade hemodinâmica não haverá tempo para aguardar os efeitos das
drogas, e o tratamento de escolha será a imediata cardioversão elétrica.
No flutter atrial a cardioversão elétrica sincronizada (50J e a seguir,
100J,200J,300J e 360J) é a conduta definitiva preconizada, visto que o
tratamento farmacológico apenas reduz a freqüência ventricular.
A fibrilação atrial que surge nas primeiras 48 hs da evolução do IAM, quase
sempre indica grave doença isquêmica, comprometimento multiarterial,
insuficiência cardíaca e maior risco de morte súbita. A conduta terapêutica
vai depender do comprometimento hemodinâmico e da freqüência cardíaca
podendo exigir apenas medidas de seu controle (digital, &- 98; bloqueadores,
verapamil, diltiazem ou amiodarona) ou cardioversão elétrica sincronizada
imediata (iniciando com 100J e, se necessário, aumentar para 200, 300,
360J). Não havendo contra-indicações heparinizar sempre.
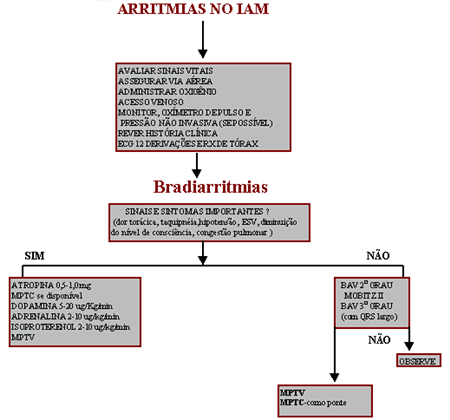
A bradicardia sinusal é mais freqüente em IAM inferior devido a
hiperatividade vagal. O tratamento é instituído se a freqüência cardíaca for
inferior a 50 bpm associada à instabilidade hemodinâmica usando-se atropina
0,5 a 1,0 mg IV a cada 5 minutos, com dose máxima de 3mg. Nos pacientes que
não respondam a esta intervenção está indicado marca-passo provisório (MP).
O bloqueio atrio ventricular (BAV) de 1º grau assintomático não requer
tratamento, entretanto, quando houver comprometimento hemodinâmico,
bradicardia significativa e/ou bloqueio de ramo, o MP deverá ser instalado.
O BAV 2º Mobitz I é mais freqüente no IAM inferior, geralmente é transitório
e não necessita de tratamento. Se provoca comprometimento hemodinâmico ou
bradicardia significativa emprega-se a atropina.
O BAV 2º Mobitz II é mais freqüente em IAM anterior com comprometimento
tri-fascicular, por necrose do tecido de condução, exigindo a colocação de
marcapasso.
O BAV total no IAM inferior é geralmente transitório podendo responder ao
uso de atropina. No infarte anterior é geralmente devido a necrose
envolvendo o nódulo AV, septo e tecido de condução. Quando o QRS é largo há
a possibilidade de evoluir para assistolia. O tratamento nos dois casos se
faz com marca passo provisório.
O hemi-bloqueio posterior esquerdo geralmente traduz comprometimento de
grande área miocárdica, embora raro, sua maior incidência ocorre na
insuficiência ventricular esquerda aguda. O hemi-bloqueio anterior esquerdo
raramente evolui para BAV total e não necessita de tratamento. Os bloqueios
bi fasciculares apresentam grande risco de evoluir para BAV total e surgem
em pacientes com grande área miocárdica comprometida.
Os bloqueios trifasciculares, se já existentes, não podem ser atribuidos a
doença aguda. Quando surgem durante a evolução da doença emprega-se o marca
passo provisório. O BRD pode estar relacionado à IAM extenso, carretando
aumento da mortalidade.
Quando utilizamos o marcapasso transcutâneo (MPTC), devemos ter certeza que
este está capturando, e que o paciente pode tolerar a estimulação. Se a dor
da estimulação tornar-se um grande problema, devemos estar preparados para
fornecer analgésicos IV, relaxantes muscularse e ansiolíticos. Ë empregado
como "ponte" enquanto se providencia o implante do marcapasso provisório
transvenoso.
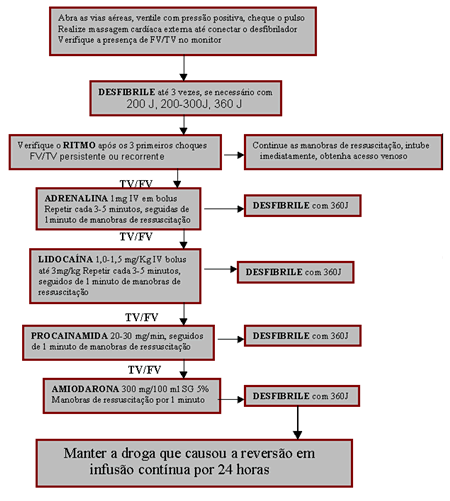
A taquicardia ventricular (TV) é definida pela presença de três ou mais
batimentos com QRS largo e pode ser:
sustentada - mantém-se por mais de 30 segundos e/ou gera instabilidade
hemodinâmica;
não sustentada - duração menor do que 30 segundos e geralmente sem
instabilidade hemodinâmica; monomórfica - QRS constante;
polimórfica- QRS com múltiplas morfologias.
A TV monomórfica é um ritmo incomum no IAM nas fases iniciais e geralmente
apresenta freqüência ventricular menor do que 170 batimentos por minuto (Quadro
). A TV polimórfica deve ser tratada como fibrilação ventricular.
A atividade elétrica sem pulso (dissociação eletromecânica, pseudo-dissociação
eletromecânica, ritmo idioventricular, ritmo ventricular de escape, ritmos
bradi-sistólicos e ritmo idioventricular pós desfibrilação) ocorre no IAM
extenso e apresenta prognóstico muito ruim, exigindo manobras de
ressuscitação cardio-pulmonar e se possível ecocardiograma.
O algoritmo para tratamento da fibrilação ventricular (FV) e taquicardia
ventricular (TV) sem pulso é exemplificado à seguir:
VII - Cirurgia Cardíaca após o infarto do miocárdio
Acompanhando a evolução da medicina cardiovascular, particularmente a
terapia trombolítica e procedimentos baseados em cateteres, as técnicas
cirúrgicas evoluíram e a preservação miocárdica intra e perioperatórias foi
reformulada. Para lidar com tais circunstâncias, a estratégia de proteção
miocárdica evoluiu da minimização do insulto isquêmico à tentativa de
ressuscitação ativa do coração durante o procedimento cardiocirúrgico.
O momento adequado para revascularização cirúrgica após o infarto do
miocárdio ainda é controverso. A isquemia persistente, caracterizada por
angina recidivante ou por alterações no ECG, apesar da terapia clínica, deve
incentivar o cateterismo cardíaco e a revascularização miocárdica quando
indicada. O uso de antiocoagulantes ou de prévia terapia trombolítica não
deve ser visto como contra-indicação à intervenção cirúrgica.
Tradicionalmente, recomenda-se uma espera de 4 a 6 semanas para permitir a
cicatrização do infarto e evitar a sua transformação em infarto hemorrágico
com revascularização por enxertos. Esta recomendação baseia-se em dados que
mostram mortalidade cirúrgica de 8% a 10%, se a cirurgia é realizada
precocemente, isto é, nas primeiras duas semanas após o infarto do
miocárdio. Séries mais recentes mostram pouco aumento da mortalidade com a
intervenção cirúrgica "eletiva" na 1ª semana do infarto. O que parece claro
é que se a função ventricular esquerda está preservada, o momento da
intervenção cirúrgica não importa.
VIII- Orientações PÓS-IAM
Os pacientes considerados de alto risco (presença de angina pós-IAM,
complicações mecânicas e elétricas) devem realizar coronariografia visando
procedimentos de revascularização.
A realização do teste ergométrico limitado por sintomas imediatamente antes
da alta hospitalar do paciente acometido de IAM - 4 a 7 dias pós-evento
agudo - tem se tornado uma recomendação clínica e um procedimento
relativamente frequente. Esse exame auxilia na estratificação do prognóstico
do paciente e pode contribuir de forma significativa para uma melhor
definição da conduta médica.
Recomenda-se que seja realizado um protocolo atenuado, em cicloergômetro ou
em esteira rolante, de modo que uma intensidade em torno de 4 ou 5
equivalentes metabólicos (MET) possa ser alcançada em cerca de 6 a 8 minutos
(0,5 MET/min de incremento). Os dados obtidos nesse teste permitem uma
orientação minuciosa e fundamentada da atividade física que será permitida
ao paciente no pós-alta. A resposta isquêmica com baixo nível de exercício,
a impossibilidade de alcançar 4 METs ou a hipotensão com o exercício
indicará a realização de coronariografia. Deve ser realizado novamente com 3
a 6 semanas se foi submáximo na internação.
Na impossibilidade do TE, quer pelas anormalidades do ECG basal (bloqueio de
ramo esquerdo, alterações maiores do segmento ST, uso de digital, ritmo de
marcapasso e síndrome de pré-excitação) quer pela incapacidade do paciente
para o exercício, devemos utilizar a cintigrafia miocárdica ou
ecocardiograma de estresse, considerando-se custos, disponibilidade e
experiência do grupo.
A cintigrafia e o eco de estresse são indicados na avaliação do tamanho do
IAM e/ou extensão do miocárdio sob risco, na avaliação da função ventricular
e viabilidade miocárdica.
A realização de ECG dinâmico (Holter), ECG de alta resolução, dispersão do
QT, variabilidade do intervalo RR não são recomendados de rotina após o IAM,
exceto em casos particulares quando associada à outros determinantes de mau
prognóstico no IAM (baixa fração de ejeção, TE positivo com baixas cargas e
arritmias ventriculares tardias).
A coronariografia é recomendada no pós- IAM nas
seguintes situações:
-
Episódios de isquemia miocárdica espontâneos ou
provocados por mínimos esforços durante a recuperação do IAM e/ou angina
pós-IAM.
-
Antes da terapêutica definitiva de complicações
mecânicas tais como: regurgitação mitral aguda, comunicação
interventricular, pseudoaneurismas ou aneurisma de VE.
-
Instabilidade hemodinâmica persistente, disfunção de VE
(FE menor ou igual a 40%) e/ou insuficiência cardíaca congestiva
-
Infarto do miocárdio ou revascularização miocárdica (ATC ou cirurgia) prévios.
-
Arritmias ventriculares malignas
-
Suspeita de causas não trombóticas para o IAM como:
espasmos, embolia coronariana e causas metabólicas e hematológicas
Em relação a manutenção de drogas, o uso continuado de aspirina provou
ser capaz de reduzir o risco de IAM e o risco de acidente vascular
cerebral não fatal, a dose média recomendada é de 200 mg por toda a vida.
Todos os pacientes que não apresentem uma definitiva contra-indicação ao
uso dos betabloqueadores devem fazer uso destas drogas indefinidamente
pela redução da mortalidade global que produzem. O uso de IECA iniciado
na fase aguda, demonstrou ser efetivo no IAM da parede anterior ou
naqueles com fração de ejeção < 40%, por um período, de pelo menos, 6
meses após o IAM, por sua capacidade de prevenir a remodelação e
conseqüente dilatação cardíaca. Os anticoagulantes (warfarin em doses
para manter o INR entre 2.0 e 3,0) devem ser usados naqueles paciente
que apresentem fibrilação atrial persistente após o IAM, e em pacientes
com documentação de trombo em VE, neste último por seis meses.
Abandonar o hábito de fumar é essencial para a prevenção
secundária do IAM , já que o tabagismo dobra a mortalidade global, promove
vasoespasmo coronariano e reduz os efeitos anti-isquêmicos dos
betabloqueadores. O paciente deve ser orientado para a prática de exercícios
físicos de acordo com o resultado do teste ergométrico. Sua dieta deve
conter índices menores que 7% de gorduras saturadas e menos que 200 mg/dia
de colesterol. Os pacientes que apresentam valores superiores a 125 mg/dl de
LDL (maiores benefícios) e/ou os com níveis entre 100 a 130 mg/dl , após
implementação da dieta, devem receber drogas a fim de reduzir esses valores
para um patamar inferir à 100 mg/dl. Os pacientes que possuem a HDL
colesterol em níveis inferiores a 35 mg/dl devem ser estimulados, mais
vigorosamente, à prática de exercícios físicos
IX- REABILITAÇÃO CARDÍACA:
Os programas de reabilitação promovem aderência ao tratamento, diminuem o
estresse emocional, melhoram a qualidade de vida, reduzem a mortalidade
cardiovascular e o risco de eventos coronarianos subsequentes, diminuindo
ainda os sintomas decorrentes de isquemia. Na vigência de IAM, a imobilidade
completa na posição de decúbito produz rápida deterioração física,
primariamente causada por hipovolemia, devendo-se restringi-la ao mínimo
indispensável. A tendência atual é manter o paciente cada vez menos tempo
internado, o que muitas vezes impede uma abordagem mais específica em
relação a atividade física.
Em geral, passadas algumas horas sem precordialgia e com estabilização
hemodinâmica, permite-se de forma cuidadosa e progressiva, a realização de
pequenos movimentos ainda no leito (ex: movimentação ativa dos pés). Na
evolução não complicada é conveniente que o paciente sente-se ainda no leito
apoiando os pés sobre os degraus de uma escada duas ou três vezes por dia
durante alguns minutos. No dia subsequente, o paciente pode sentar-se em uma
cadeira fora do leito por uma hora. Incrementos de frequência cardíaca de
até 25 bpm (15 bpm nos ß-bloqueados) são bastante aceitáveis para cada uma
dessas situações e auxiliam na progressiva liberação.
Ao sair da unidade coronariana o paciente deve ser estimulado para não se
manter deitado por períodos prolongados e pequenas caminhadas algumas vezes
por dia (10 a 20 metros), pelos corredores, são normalmente permitidas.
É fundamental que o médico assistente comece a traçar diretrizes para a
atividade física que será permitida ao paciente no período pós alta imediato
X- Transporte terrestre do paciente com IAM:
Quando consideramos o transporte para o paciente portador de IAM, devemos
avaliar os riscos e os benefícios dele decorrente, já que o mesmo significa,
sempre, um período de instabilidade. O transporte deve ser feito por um
médico e um profissional de enfermagem com habilidade em socorrer pacientes
em situação de emergência, capazes de prover os mesmos recursos que o
paciente necessitava em sua Unidade de origem, acrescidos da capacitação
para o tratamento de possíveis complicações que ocorram no curso do trajeto
(ex: desfibrilação, entubação, etc). Assim, dentro do possível, todos os
procedimentos devem ser implementados dentro da Unidade especializada (à
beira do leito) e o transporte, quando imprescindível, ser cuidadosamente
planejado, evitando-se piora do quadro clínico.
Antes da realização do transporte, a Unidade que receberá o paciente deve
ser informada de seu quadro clínico e prováveis complicações, confirmando-se
a disponibilidade, naquele local, dos recursos requeridos. Caso o mesmo se
faça para a realização de exame complementar (ex: angiografia), o
procedimento deve ser iniciado logo após a chegada do mesmo ao local e os
profissionais de saúde responsáveis por seu tratamento devem ser informados
de sua localização, para intervir em eventos agudos ocorridos em outra área
do hospital.
No transporte interhospitalar uma cópia do relatório médico detalhado e dos
exames complementares realizados na Unidade de origem devem acompanhar o
paciente. Durante o mesmo, será registrado em outro documento as condições
em que se fizeram o transporte, bem como suas intercorrências.
Os equipamentos requeridos para o transporte são à seguir listados, e o
melhor momento para o mesmo será a resultante da relação necessidade/estabilização
clínica
-
Monitor/desfibrilador cardíaco com eletrodos e gel,
oxímetro de pulso e aferidor de pressão não invasiva (se possível,
quando não: esfigmomanômetro e estetoscópio)
-
Marcapasso transcutâneo
-
Máscara , aspirador com sondas, ambu, tubos
orotraqueais, laringoscópio com lâminas e conexões (adequados para o
biotipo do paciente transportado), pinça de Magil, bisturi com lâmina
para cricotireoidotomia de urgência.
-
Suplementação de oxigênio que cubra o tempo previsto
para o transporte acrescidos de uma reserva de 60 minutos.
-
Drogas padrão para ressuscitação cadio-pulmonar-cerebral
e terapêutica de urgência sugerida (adenosina, adrenalina, água
destilada, aminofilina, amiodarona, atropina, bicarbonato de sódio,
cedilanide, cloreto ou gluconato de cálcio, cloreto de sódio e de
potássio, dexametasona, difenilhidantoína, diazepam, diltiazem, dopamina,
dobutamina, enalapril venoso, furosemida, heparina, lidocaína para
infusão IV e spray, manitol, metoprolol, midazolan, morfina, naloxone,
nitroglicerina venosa, nitroprussiato de sódio, procainamida,
propranolol, sulfato de magnésio, verapamil)
-
Bombas infusoras para soluções em uso e estoque
adicional das mesmas para eventuais substituições
-
Respirador de transporte que promova os mesmos
parâmetros em uso: fração inspirada de O2, volume minuto e pressão
positiva no final da expiração (se possível com alarmes de alta pressão
em vias aéreas)
-
Materiais para infusão venosa, como cânulas, catéteres,
seringas, agulhas, solução fisiológica, glicosada, Ringer e colóides.
-
Meio de comunicação como telefone ou sistema de rádio.
-
Documento onde conste a autorização para o transporte
dos familiares ou responsáveis pelo doente; caso não estejam disponíveis,
a anotação do fato deve ser claramente registrada.
XI. Bibliografia Sugerida
http://www.saude.gov.br/
-
Ryan TJ, Anderson JL, Antman EM, Braniff BA, Brooks NH, Califf RM, et al.
ACC/AHA guidelines for the management of patients with acute myocardial
infarction: A report of the American College of Cardiology / American Heart
Association Task Force on Practice Guidelines (Committee on Management of
Acute Myocardial Infarction). J Am Coll Cardiol 1996; 28: 1328-1428.
-
Fuster V. Coronary thrombolysis: a perspective for the practicing physician.
N Engl J Med 1993;329: 723-725.
-
Simoons ML, Arnold AE. Tailored thrombolytic therapy: a perspective.
Circulation 1993; 88: 2556-2564.
-
ISIS-3 ( Third International Study of Infarct Survival ) Collaborative
Group. A randomized comparison of streptokinase vs tissue plasminogen
activator vs anistreplase and of heparin vs aspirin alone among 41 299 cases
of suspect acute myocardial infarction: ISIS-3. Lancet 1992; 339: 753-770.
-
The GUSTO Angiographic Investigators. The effects of tissue plasminogen
activator, streptokinase, or both on coronary-artery patency, ventricular
function, and survival after acute myocardial infarction. N Engl J Med
1993;1615-1622.
-
White HD, Yusuf S. Issues regarding the use of heparin following
streptokinase therapy. J Thrombosis Thrombolysis 1995; 2:5-10.
-
Mahaffey KW, Granger CB, Collins R, et al. Overview of randomized trials of
intravenous heparin in patients with acute myocardial infarction treated
with thrombolytic therapy. Am J Cardiol 1996; 77:551-556.
-
TIMI Study Group -Thrombolysis in Miocardial Infarction. Phase 1:
Circulation 1987;72:817-29
-
Nunn C, O’Neill W, Rothbaum D, O;Keefe, Overlie P, Donohue B, Mason D,
Catlin, Grines C. Primary Angioplasty for Myocardial Infarction Improves
Long-Term Survival: PAMI-1 Follow-up. ACC 1996
-
Bates, ER., Topol, EJ. Limitations of thrombolytic therapy for acute
myocardial infarction complicated by congestive heart failure and
cardiogenic shock. J Am Coll Cardiol 1991;18:1077-84
-
Stone GW, Brodie BR, Griffin JJ, Morice MC, Constantini C, Goar FG, Overlie
PA, Popma JJ, McDonell, Jones D, O’Neill WW, Grines CL, for the Primary
Angioplasty in Myocardial Infarction (PAMI) Stent Pilot Trial Investigators.
Prospective, Multicenter Study of the Safety and Feasibility of Primary
Stenting in Acute Myocardial Infarction: In Hospital and 30-Day Results of
the PAMI Stent Pilot Trial. J Am Coll Cardiol 1998;31(1):23-30
-
Stone GW, Marsalese D, Brodie BR, Griffin JJ, Donohue B, Constantini C,
Balestrini C, Wharton T, Esente P, Spain M, Moses J, Nobuyoshi M, Ayres M,
Jones D, Mason D, Grines L, O’Neill WW, Grines CL. A Prospective, randomized
evaluation of prophylatic intraaortic balloon counterpulsation in high risk
patients with acute myocardial infarction treated with primary angioplasty.
Second primary angioplaty in myocardial infarction (PAMI-II) trial
investigators. J Am Coll Cardiol 1997;29(7):1459-67
-
Stone et al. Primary stenting in acute myocardial infarction: PAMI Stent
Pilot Trial. J Am Coll Cardiol 1998;31(1):23-30
-
Stone GW Primary Stenting in Acute Myocardial Infarction: The Promise and
the Proof. Editorials. Circulation 1998;97:2482-85
-
Feitosa GS, Batlouni M, Castro I, et al: Consenso sobre tratamento do
pós-infarto do miocárdio. Arq Bras Cardiol 1995; 64:271-96.
-
Pepine CJ: Aspirin and newer orally active antiplatelet agents in the
treatment of the post-myocardial infarction patient. J Am Coll Cardiol
1998;32:1126-8.
-
Yusuf S, Collins R, MacMahon S: Effect of intravenous nitrates on mortality
in acute myocardial infarction: An overview of the randomized trials. Lancet
1988;1:1088-92.
-
ISIS-4 Collaborative Group: ISIS-4: A randomized factorial trial assessing
early oral captopril, oral mononitratre, and intravenous magnesium sulphate
in 58,050 patients with suspected acute myocardial infarction. Lancet
1995;345:669-85.
-
Held PH, Yusuf S: Effects of B-blockers and calcium channel blockers in
acute myocardial infarction. Eur Heart J 1993;14(suppl F):18-25.
-
The MIAMI Trial Research Group: Metoprolol in acute myocardial infarction: a
randomized placebo-controlled international trial. Eur Heart J
1985;6:199-266.
-
Norris RM, Clarke ED, Samuel NL, et al: Protective effect of propranolol in
threatened myocardial infarction. Lancet 1978;2:907-9.
-
Herlitz J, Emanuelsson H, Swedberg K, et al: Göteborg metoprolol trial:
enzyme-estimated infarct size. Am J Cardiol 1984;53(suppl D):15-21.
-
The MIAMI Trial Research Group: Development of myocardial infarction. Am J
Cardiol 1985;56(suppl G):23-6.
-
ISIS-1 Collaborative Group: Randomized trial of intravenous atenolol among
16,027 cases of suspected acute myocardial infarction:ISIS-1. Lancet
1986;2:57-66.
-
Pfeffer MA, Braunwald E, Moye L, et al. Effect of captopril on mortality and
morbidity in patients with left ventricular dysfunction after myocardial
infarction. Results of the Survival and Ventricular Enlargement trial. N
Engl J Med 1992;327:669-77.
-
The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators: Effect of
ramipril on mortality and morbidity of survivors of acute myocardial
infarction with clinical evidence of heart failure. Lancet 1993;342:821-8.
-
GUSTO II Angioplasty Substudy Investigators: An international randomized
trial of 1138 patients comparing primary coronary angioplasty versus tissue
type plasminogen activator for acute myocardial infarction. N Engl J Med
1997;336:1621-8.
-
Woods KL, Fletcher S, Roffee C, Haider Y: Intravenous magnesium sulphate in
suspected acute myocardial infarction: Results of the Second Leicester
Intravenous Magnesium Intervention Trial (LIMIT-2). Lancet 1992; 339:1553–8.
-
Antman EM: Magnesium in acute MI: Timing is critical. Circulation 1995;
92:2367–72.
-
Chatterjee K. Myocardial infarction shock. Crit Care Clin 1985; 1: 563 –
590.
-
Cummins RO. Advanced cardiac life support. Dallas: American Heart
Association, 1997.
-
Dellinger RP. Fundamental critical care support. Anaheim: Society of
Critical Care Medicine, 1997.
-
Goldstein RA, Passmore JM. Hemodynamic support of the critically ill
patient. In: Dantzker DR, ed. Cardiopulmonary critical care. Philadelphia:
WB Saunders Company, 1991: 635-640.
-
Passmore JM, Goldstein RA. Acute recognition and management of congestive
heart failure. Crit Care Clin 1989; 5: 497-532.
-
Sociedade de Cardiologia do Estado do Rio de Janeiro. I Consenso sobre
manuseio terapêutico da insuficiência cardíaca. Rev SOCERJ 1998; II (suppl):
1 – 25.
-
Willians JF et al. ACC/AHA guidelines for evaluation and management of heart
failure: A report of the American College of Cardiology / American Heart
Association Task Force on Practice. J Am Coll Cardiol 1995; 26: 1376-1398.
-
Allen BS, Rosenfranz E, Buckberg GD, et al: Studies on prolonged acute
regional ischemia: VI. Myocardial infarction with left ventricular power
failure: A medical/ surgical emergency requiring urgent revascularization
with maximal protection of remote muscle. J Thorac Cardiovasc Surg 1989; 98:
691,
-
Bates RJ, Beutles S, Resnekov L, et al: Cardiac rupture: Challenge in
diagnosis and management. Am J Cardiol 1997; 40:429,
-
Bolooki H, Vargas A: Myocardial revascularization after acute myocardial
infarction. Arch Surg 1976; 111:1216,
-
Clements SD, Story WE, Hurst JW, et al: Ruptured papillary muscle, a
complication of myocardial infarction: Clinical presentation, diagnosis and
tretment. Clin Cardiol 1985; 8:93,
-
Dion R: Ischemic mitral regurgitation: When and how should it be corrected?
Haert Valve Dis 1993; 5:536,
-
Dresdale AR, Paone G: Surgical treatment of acute myocardial infarction.
Henry Ford Hospital Medical Journal 1991;39:245,
-
Fox AC, Glassman E, Isom OW: Surgical remediable complications of myocardial
infarction. Prog Cardiovasc Dis 1979;21:461,
-
Heitmiller R, Jacobs ML, Daggett WM: Surgical management of postinfarction
ventricular septal rupture. Ann Thorac Surg 1986;41:683-691
-
Moosri AR, Khaja F, Villanueva L. et al: Early revascularization improves
survival in cardiogenic shock complicating acute myocardial infarction. J Am
Coll Cardiol 1992; 19:907,
-
Sharp TF, Kessler KA: Surgical myocardial revascularization after acute
infarction. Chest 1993;104:1063,
-
Tcheng JE, Jackman JD Jr, Nelson CL, et al: Outcome of patients sustaining
acute ischemic mitral regurgitation during myocardial infarction. Ann Intern
Med 1992;117:18,
-
Wellons HÁ, Schneider JA, Mikell FL, et al: Early operative intervention
after thrombolytic therapy for acute myocardial infarction. J Vasc Surg
1985; 2:186,
-
Teo KK, Yusuf S, Furberg CD. Effects of prophylactic antiarrhythmic drug
therapy in acute myocardial infarction: an overview of results from
randomized controlled trials. JAMA. 1993; 270: 1589-1595.
-
ACC/AHA GUIDELINES FOR IMPLANTATION OF CARDIAC PACEMAKERS AND ANTIARRHYTHMIA
DEVICES. J Am Coll Cardiol 1998; 31: 1175-1209.
-
Reeder GS, Gibbons RJ. Acute myocardial infarction: risk stratification in
the thrombolytic era. Mayo Clin Proc 1995; 70: 87-94.
-
McGhie AI, Willerson JT, Corbett JR. Radionuclide Assessment of ventricular
function and risk stratification after myocardial infarction. Circulation.
1991; 84[suppl 1] : I 167-I 176.
-
ACC/AHA GUIDELINES FOR THE CLINICAL APPLICATION OF ECHOCARDIOGRAPHY –
SECTIONS IV-V. Circulation 1997; 95: 1686-1744.
-
ACC/AHA GUIDELINES FOR EXERCISE TESTING. J Am Coll Cardiol 1997; 30:
260-315.
-
How to implement physical activity and primary and secundary prevention.
Ciculation 1997; 96: 355-357.
|